Segundo Geissman e Crout (Organic Chemistry of Secondary Plant Metabolism, 1969), substâncias do metabolismo secundário são de natureza relativamente complexa e distribuição restrita, ao contrário das substâncias do metabolismo primário que apresentam uma distribuição universal. Poucos produtos naturais possuem uma função característica bem determinada no metabolismo dos organismos que as produzem. Contudo, também não podem ser considerados como “lixo metabólico”, “anomalias funcionais”, ou ainda produtos finais de degradação do metabolismo primário. Sua função é desconhecida pela nossa incapacidade de estabelecê-la.
Segundo Luckner (Secondary Metabolism in Plants and Animals, 1972), o metabolismo secundário é constituído por uma infinidade de substâncias que em geral são consideradas produtos de excreção, fonte de energia ou produtos de estocagem (?) sem qualquer importância para os organismos que as produzem.
Segundo Martin e Demain (in The Filamentous Fungi, 1978, vol. III), no caso de microorganismos, metabolitos secundários são os produtos do metabolismo que são quase sempre produzidos após a fase de crescimento, não apresentando função durante o crescimento, embora possam apresentar função essencial para a sobrevivência da linhagem (ex., antibióticos). São produzidos por grupos específicos de microorganismos, apresentam estruturas químicas pouco usuais, e quase sempre ocorrem na forma de misturas de compostos muito semelhantes.
Segundo Mann (Secondary Metabolism, 1980), os produtos do metabolismo secundário são substâncias pretencentes a um único organismo, ou a um pequeno grupo de organismos [geneticamente] relacionados. Na maioria das vezes, são substâncias que não são absolutamente essenciais para a manutenção da vida dos organismos que as contém, em contraste aos outros compostos de origem natural, açúcares, aminoácidos, nucleotídeos e seus respectivos polímeros, os quais são todos essenciais e ubíquos (de ampla ocorrência).
Segundo Herbert (The Biosynthesis of Secondary Metabolites, 1981), substâncias do metabolismo primário constituem as principais vias de uma linha de trem; as substâncias do metabolismo secundário constituem as ramificações dessas linhas, e aonde chegam a seu termo. Produtos do metabolismo secundário podem ser distingüidos daqueles do metabolismo primário, de acordo com as seguintes premissas:
– apresentam distribuição restrita, sendo limitadas a plantas e microorganismos, sendo ainda restritas a grupos pertencentes a um mesmo gênero, espécie ou linhagem;
– são formadas a partir das substâncias do metabolismo primário;
– não são essenciais para a manutenção da vida, sendo, porém, importantes para os organismos que as produzem. Qual é essa importância? Boa pergunta.
– são formadas a partir de um número limitado de substâncias do metabolismo primário: aminoácidos, acetil-coenzima A, ácido mevalônico, e intermediários do metabolismo do ácido shiquímico.
Segundo Manitto (Biosynthesis of Natural Products, 1981), produtos naturais são substâncias que não são essenciais para a existência dos indivíduos como tais, mas que exercem uma função fundamental para a sobrevivência da espécie. A real razão para a sua produção é desconhecida.
Segundo Torsell (Natural Products Chemistry, 1983), produtos do metabolismo secundário são característicos de um determinado grupo biológico, tal como uma determinada família ou gênero, e a forma pela qual são biossintetizados é resultado da história evolutiva do(s) organismo(s) que as produzem. Sua real função é, no mais das vezes, desconhecida. Porém, não são “lixo metabólico”, em vista do fato que vários produtos naturais são acumulados em quantidades apreciáveis pelos organismos que os produzem. Produtos naturais podem ser considerados como substância de pouco ou nenhum valor nutricional, e que controlam a biologia de outras espécies no ambiente em que se encontram. Em outras palavras, produtos naturais apresentam uma função fundamental na co-existência e na co-evolução das espécies biológicas, podendo atuar como:
– mediadores de atração sexual;
– estimulantes de consumo (feedants), ou inibidores de consumo (anti-feedants), repelentes ou toxinas;
– mecanismos de defesa e de alarme (em animais);
– mediadores químicos nos processos de desenvolvimento, metamorfose, estimuladores ou supressores de crescimento;
– mediadores em processos de interação social, agindo como agentes estimulantes de construção (cupins); marcadores territoriais (abelhas); indicadores de trilhas (formigas), etc.
Segundo Davies (in Microbiology, 1985), a definição mais simples de produtos do metabolismo secundário é que estes não se encontram nos mapas metabólicos do metabolismo primário.
Segundo Bennett e Bentley (in Advances in Applied Microbiology, 1989, 34, 1), produtos do metabolismo secundário constituem intermediários ou produtos metabólicos, quase sempre (mas nem sempre!) restritos a grupos taxonômicos específicos, sendo biossintetizados a partir de um ou mais precursores metabólicos através de uma série de reações enzimáticas.
Segundo Luckner (Secondary Metabolism in Microorganisms, Plants and Animals, 1990) a biossíntese de produtos secundários é, no mais das vezes, pouco onerosa para as células que a realizam (!!), porém essas substâncias apresentam funções essenciais no desenvolvimento e função (?) do organismo que as produz. As principais características dessas substâncias são:
– a sua distribuição taxonômica restrita;
– sua formação (biossíntese), envolvendo enzimas específicas;
– a compartimentalização (em vesículas e organelas especializadas) das enzimas, dos precursores, intermediários e produtos envolvidos na sua biossíntese;
– controle da biossíntese, através da disponibilização das enzimas responsáveis por sua realização;
– a expressão do metabolismo secundário (produção e liberação intra-celular e extra-celular) em função da fase do crescimento e do desenvolvimento do organismo produtor;
– a enorme variação estrutural de substâncias estruturalmente relacionadas;
– a pouca importância dessas substâncias para as células que as produzem, mas sendo primordiais para o organismo como um todo (?).
Segundo Vining (in Secondary Metabolites: their function and evolution, 1992), 1. No caso de microorganismos, metabolitos secundários não são essenciais para o crescimento e tendem a ser espécie-específicos; 2. Apresentam uma grande variedade estrutural e de atividades biológicas; 3. São formados através de rotas biossintéticas particulares, a partir de produtos do metabolismo primário e intermediários.
Segundo Hunter (in Trends in Biotechnology, 1992, 10, 144), no caso de microorganismos, o metabolismo secundário é constituído por rotas bioquímicas que são desnecessárias para o crescimento e reprodução, mas tas rotas são constitutivas e parte da expressão genética, fisiológica de bioquímica de um ou um grupo de organismos.
Considerando os pontos apresentados por estes autores, podemos propor uma definição geral para os produtos do metabolismo secundários (denominados ‘produtos naturais’ ou ‘metabólitos secundários’):
– São substâncias distintas dos blocos bioquímicos comuns a todos os seres vivos: açúcares, nucleosídeos, aminoácidos e seus respectivos polímeros.
– Apresentam distribuição restrita a um grupo, ou grupos, genetica e taxonomicamente relacionados.
– Exercem, em geral, atividades extra-celulares alheias às células que as produzem.
– Apresentam, via de regra, funções fisiológicas e adaptativas.
– São formadas através de rotas bioquímicas caraterísticas.
– No caso de microorganismos, exercem funções outras que relacionadas ao crescimento e desenvolvimento do microorganismo, sendo em geral produzidas após o crescimento.
Curtir isso:
Curtir Carregando...







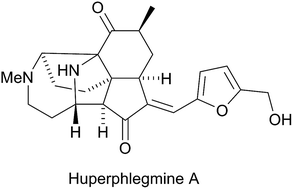




















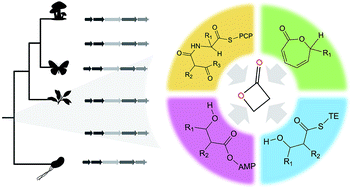
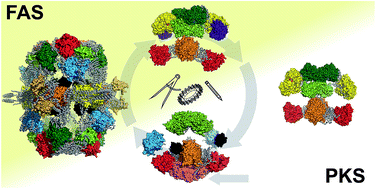
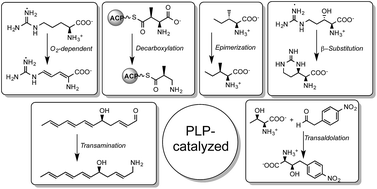

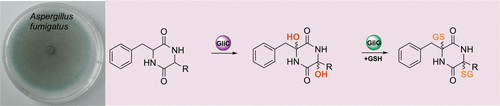
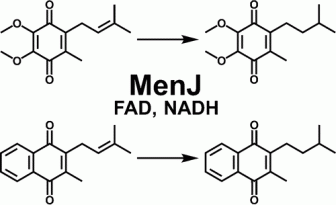
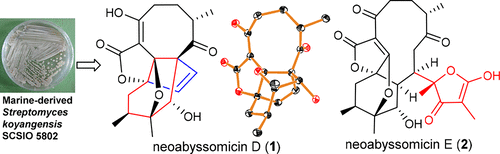

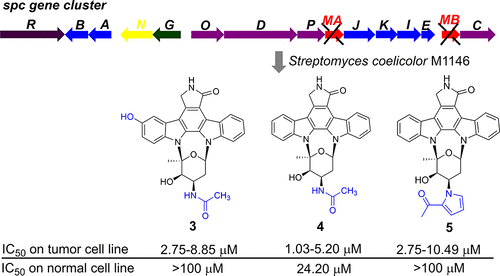
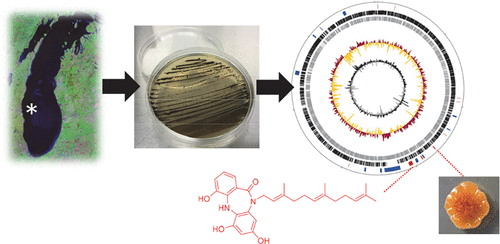
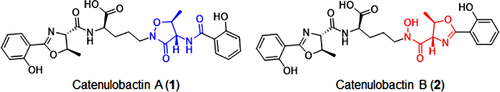
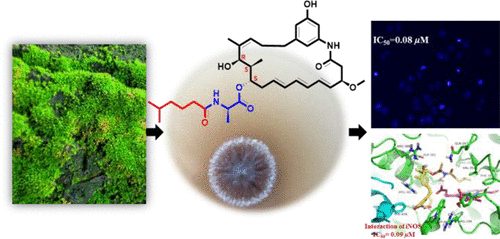
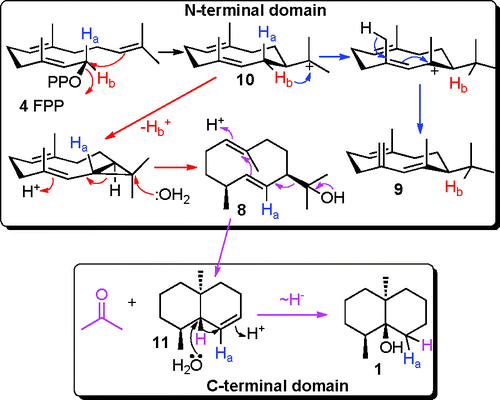

Você precisa fazer login para comentar.