ORGANIC CHEMISTRY OF BIOLOGICAL SYSTEMS
ROBERTO BERLINCK’S RESEARCH GROUP – INSTITUTO DE QUÍMICA DE SÃO CARLOS, USP

ORGANIC CHEMISTRY OF BIOLOGICAL SYSTEMS
ROBERTO BERLINCK’S RESEARCH GROUP – INSTITUTO DE QUÍMICA DE SÃO CARLOS, USP

ORGANIC CHEMISTRY OF BIOLOGICAL SYSTEMS
ROBERTO BERLINCK’S RESEARCH GROUP – INSTITUTO DE QUÍMICA DE SÃO CARLOS, USP

ORGANIC CHEMISTRY OF BIOLOGICAL SYSTEMS
ROBERTO BERLINCK’S RESEARCH GROUP – INSTITUTO DE QUÍMICA DE SÃO CARLOS, USP

NEWS
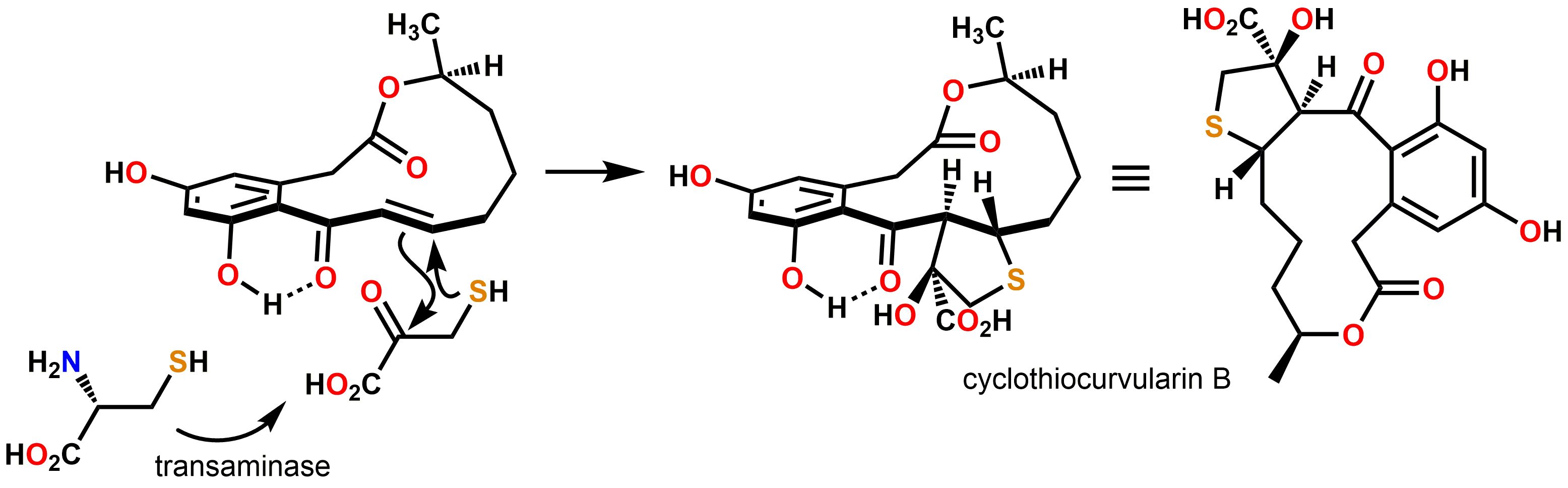
Processo “detox” de fungos resulta de adição de Michael do mercaptopiruvato em enona da alfa,beta-dehidrocurvularina
/em blog /por innovartProcesso de detoxificação do fungo Penicillium sp. descrito neste ano de 2016 resulta da adição de mercaptopiruvato no grupo enona da alfa,beta-dehidrocurvularina. Esta descoberta se sucedeu durante a investigação dos metabólitos minoritários produzidos pelo fungo em meio de cultura. De maneira a se incrementar a produção dos metabólitos minoritários, foi aplicada metodologia de planejamento experimental e análise quimiométrica utilizando-se planejamento fatorial fracionário. Experimentos de crescimento do fungo em condições otimizadas levaram à formação de derivados da alfa,beta-dehidrocurvularina que apresentam um anel tetrahidrotiofeno, as ciclotiocurvularinas. Após a identificação das ciclotiocurvularinas por análise espectroscópica (RMN, HRMS e IV), bem como por difração de raios-X, foram realizados experimentos de incorporação de [U-13C]cisteína. Estes experimentos objetivaram confirmar a biossíntese do ciclo tetrahidrotiofeno. Foi observada taxa de incorporação excessivamente alta (99%) do precursor isotopicamente marcado, sugerindo que este seria incorporado por um processo puramente químico, e não regulado enzimaticamente. Experimentos adicionais utilizando-se uma transaminase, a cisteína e a alfa,beta-dehidrocurvularina confirmaram tais hipóteses: a transformação da cisteína em mercaptopiruvato e a reação deste com alfa,beta-dehidrocurvularina constituem processo de eliminação do policetídeo citotóxico quando este é produzido em altas concentrações, um claro processo de detoxificação fúngico. Este trabalho foi realizado durante o doutorado do hoje Dr. Marcos Castro e do mestrado da aluna de doutorado Laura Pavan Ióca. Leia o artigo completo, aqui.
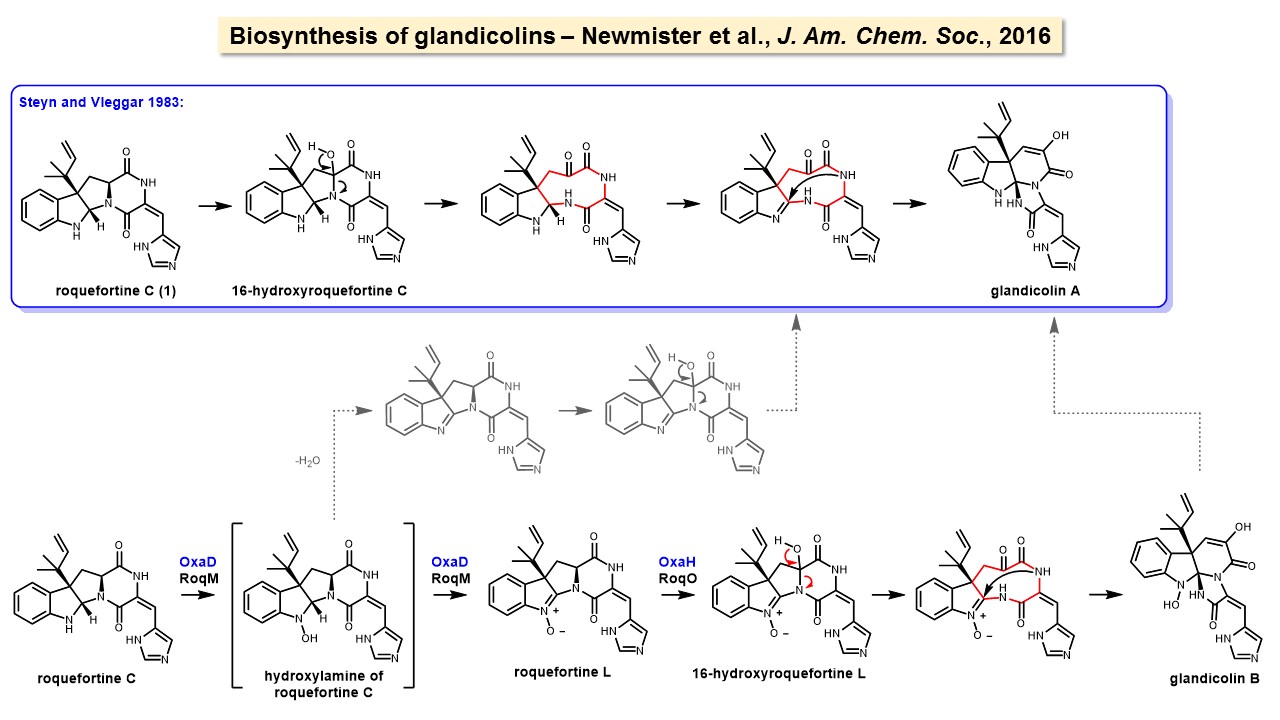
A enzima oxaD de Penicillium oxalicum oxida indóis formando nitronas
/em blog /por innovartEstudo realizado durante estágio sabático no grupo do Professor David H. Sherman do Life Sciences Institute (University of Michigan) resultou na descoberta da enzima oxaD, que promove a oxidação da roquefortina C formando roquefortina L. A roquefortina L é uma nitrona, grupo bastante raro de metabólitos secundários, dos quais até o momento se conhecem apenas 7 alcaloides, todos produzidos por fungos. A oxaD foi expressa a partir do agregado gênico (gene cluster) de Penicillium oxalicum que codifica a biossíntese da oxalina. Utilizando estratégia de expressão heteróloga em Escherichia coli eletrocompetente, a oxaD foi produzida em larga escala para que seu mecanismo de ação e flexibilidade estrutural de seu substrato natural (roquefortina C) pudessem ser investigados. Derivados da roquefortina C preparados por reações simples demonstraram ser oxidados pela enzima oxaD em maior ou menor extensão, dependendo da variação estrutural da roquefortina C. Derivados indólicos estruturalmente mais diversos não são oxidados por oxaD. A formação da roquefortina L a partir da roquefortina C promovida por oxaD é uma das etapas da biossíntese dos alcaloides oxalina e meleagrina. Este estudo foi realizado por Stelamar Romminger (bolsista CAPES), Sean Newmister (pesquisador de pós-doutorado do grupo do Prof. David Sherman), Claire Gober (aluna de doutorado da Professora Madeleine Joullié), eu mesmo (na bancada!) e outros colaboradores. O estágio sabático foi financiado pela FAPESP, enquanto que o pós-doutorado da Dra. Stelamar Romminger foi financiado pela CAPES. Leia nosso artigo, aqui.
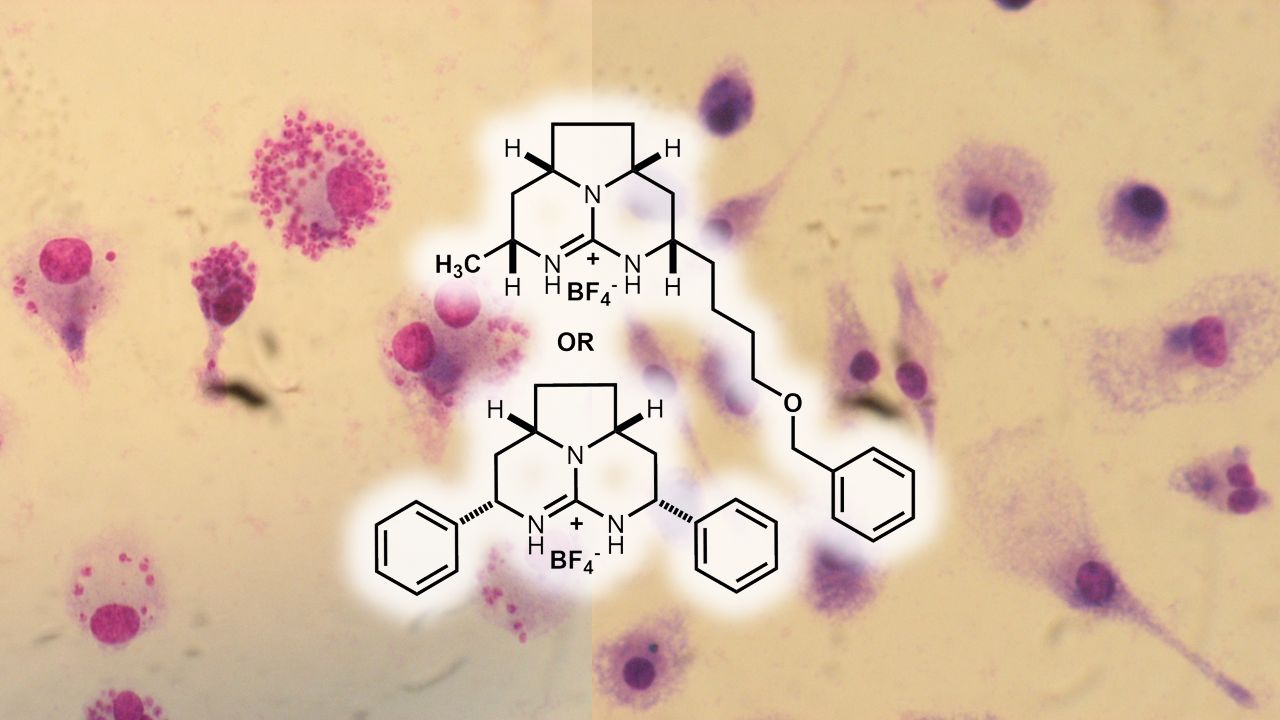
Derivados de alcaloides guanidínicos também matam Leishmania infantum e Trypanosoma cruzi
/em blog /por innovartPublicado no segundo semestre deste ano, estudo realizado por nosso grupo de colaboração coordenado pelo Dr. André Tempone do Instituto Adolfo Lutz demonstrou que derivados mais simples dos alcaloides guanidínicos isolados da esponja Monanchora arbuscula também matam os parasitas Leishmania (L.) infantum e Trypanosoma cruzi. Os derivados guanidínicos ilustrados induzem despolarização do potencial da membrana de mitocôndrias de Leishmania (L.) infantum, aumentam os níveis de espécies reativas de oxigênio e aumentam a permeabilidade da membrana plasmática dos mesmos parasitas. Os mesmos compostos promovem atividade anti-inflamatória em macrófagos infectados com Leishmania (L.) infantum co-cultivados com esplenócitos, reduzindo a produção das citocinas MCP-1 e γ-IFN. Os derivados guanidínicos ilustrados afetam o metabolismo bioenergético de Leishmania, de maneira a eliminar os parasitas de forma seletiva. O apoio financeiro da parte brasileira deste trabalho é da FAPESP (projeto temático 2013/50228-8, e bolsas de estudo 2011/23703-1 e 2013/07275-5) e do CNPq. Leia nosso artigo, aqui.
Compartilhe isso:
- Clique para compartilhar no Twitter(abre em nova janela)
- Clique para compartilhar no Facebook(abre em nova janela)
- Clique para compartilhar no WhatsApp(abre em nova janela)
- Clique para compartilhar no LinkedIn(abre em nova janela)
- Clique para imprimir(abre em nova janela)
- Clique para enviar um link por e-mail para um amigo(abre em nova janela)

Você precisa fazer login para comentar.